quarta-feira, 2 de setembro de 2015
DNA e RNA: Qual é a diferença?
É da associação dos diferentes nucleotídeos que se formam as macromoléculas dos dois tipos de ácidos nucléicos: o ácido ribonucléico (RNA) e o ácido desoxirribonucléico (DNA). Eles foram assim chamados em função dos açúcar presente em suas moléculas: O RNA contém o açúcar ribose e o DNA contém o açúcar desoxirribose.
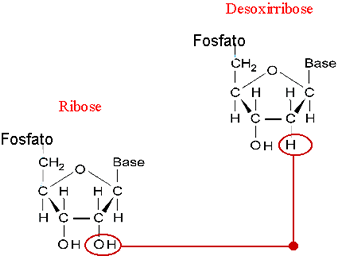
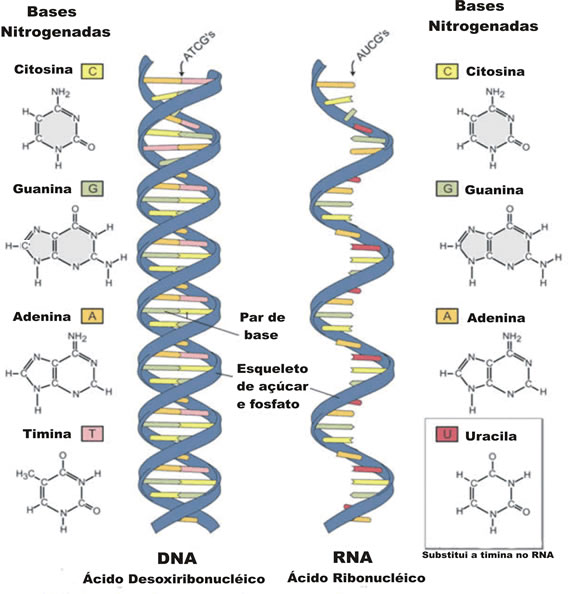
Outra diferença importante entre as moléculas de DNA e a de RNA diz respeito às bases nitrogenadas: no DNA, as bases são citosina, guanina, adenina e timina; no RNA, no lugar da timina, encontra-se a uracila. A importância e o funcionamento dos ácidos nucléicos.
Ácidos nucléicos
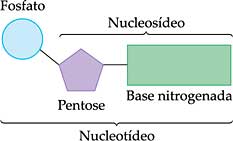
Os ácidos nucléicos são moléculas gigantes (macromoléculas), formadas por unidades monoméricas menores conhecidas como nucleotídeos. Cada nucleotídeo, por sua vez, é formado por três partes:
- um açúcar do grupo das pentoses (monossacarídeos com cinco átomos de carbono);
- um radical “fosfato”, derivado da molécula do ácido ortofosfórico (H3PO4).
- uma base orgânica nitrogenada.
Sabia-se de sua presença nas células, mas a descoberta de sua função como substâncias controladoras da atividade celular foi um dos passos mais importantes da história da Biologia
 |
. A partir do século XIX, com os trabalhos do médico suíço Miescher, iniciaram-se as suspeitas de que os ácidos nucléicos eram os responsáveis diretos por tudo o que acontecia em uma célula. Em 1953, o bioquímico norte-americano James D. Watson e o biologista molecular Francis Crick propuseram um modelo que procurava esclarecer a estrutura e os princípios de funcionamento dessas substâncias.
O volume de conhecimento acumulados a partir de então caracteriza o mais extraordinário conhecimento biológico que culminou, nos dias de hoje, com a criação da Engenharia Genética, área da Biologia que lida diretamente com os ácidos nucléicos e o seu papel biológico.
|
De seus três componentes (açúcar, radical fosfato e base orgânica nitrogenada) apenas o radical fosfato não varia no nucleotídeo. Os açucares e as bases nitrogenadas são variáveis.
Quanto aos açucares, dois tipos de pentoses podem fazer parte de um nucleotídeo: ribose e desoxirribose(assim chamada por ter um átomo de oxigênio a menos em relação à ribose.
Já as bases nitrogenadas pertencem a dois grupos:
- as púricas: adenina (A) e guanina (G);
- as pirimídicas: timina (T), citosina (C) e uracila (U).
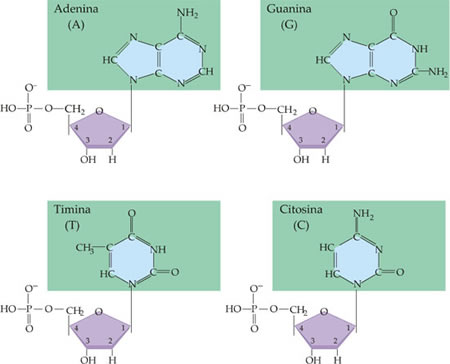
Ácidos nucleicos
Os ácidos nucleicos são macromoléculas encontradas em todas as células vivas, que constituem osgenes, responsáveis pelo armazenamento, transmissão e tradução das informações genéticas. Tais moléculas recebem esse nome devido ao seu caráter ácido e também por terem sido descobertos no núcleo celular, em meados do século XIX.
Existem dois tipos de ácido nucleico: o ácido desoxirribonucleico, mais conhecido pela sigla DNA e o ácido ribonucleico, conhecido como RNA. Os ácidos nucleicos são constituídos por três diferentes componentes:
- Pentoses: são carboidratos
cuja molécula é formada por cinco carbonos. A pentose que forma o DNA é conhecida como desoxirribose, enquanto a do RNA é chamada ribose (daí os nomes desoxirribonucleico e ribonucleico). - Bases nitrogenadas: são compostos cíclicos que contêm nitrogênio. As bases nitrogenadas são cinco: adenina, citosina, guanina, timina e uracila
; e destas somente as três primeiras são encontradas tanto no DNA quanto no RNA. A base nitrogenada timina ocorre somente no DNA, enquanto a uracila é uma base exclusiva do RNA. - Fosfato: um radical derivado da molécula do ácido fosfórico, composto químico responsável pelo caráter ácido dos ácidos nucleicos.
A união das pentoses às bases nitrogenadas e aos fosfatos forma um trio molecular que recebe o nome de nucleotídeo. Ambos os tipos de ácidos nucleicos são compostos por uma sequência de nucleotídeos, que são ligados entre si por meio dos radicais fosfatos, formando longas cadeias polinucleotídicas. Os nucleotídeos detêm grandes quantidades de energia, o que contribui para a realização de diversos processos metabólicos.
Os ácidos nucleicos apresentam uma estrutura espacial bastante complexa e peculiar. As moléculas de DNA são constituídas por duas cadeias polinucleotídicas enroladas uma sobre a outra, o que se assemelha com uma grande escada helicoidal. Essas duas cadeias se unem por meio de pontes de hidrogênio entre determinados pares de bases nitrogenadas: a adenina emparelha-se com a timina, enquanto citosina emparelha-se com guanina.
Já as moléculas de RNA, em geral, são compostas por uma única cadeia, que é enrolada sobre si mesma por meio do emparelhamento das bases complementares num mecanismo semelhante ao do DNA, no entanto, no RNA a adenina emparelha-se com a uracila. Em alguns casos, o RNA também pode ter dupla-fita, como é o caso do mosaico do tabaco.
Além do núcleo celular, o DNA também está presente nas mitocôndrias e nos cloroplastos, organelas capazes de sintetizá-lo. A partir do DNA são transcritas as moléculas de RNA, que podem ser de três tipos principais: RNA mensageiro (RNAm), RNA ribossômico (RNAr) e RNA transportador (RNAt).
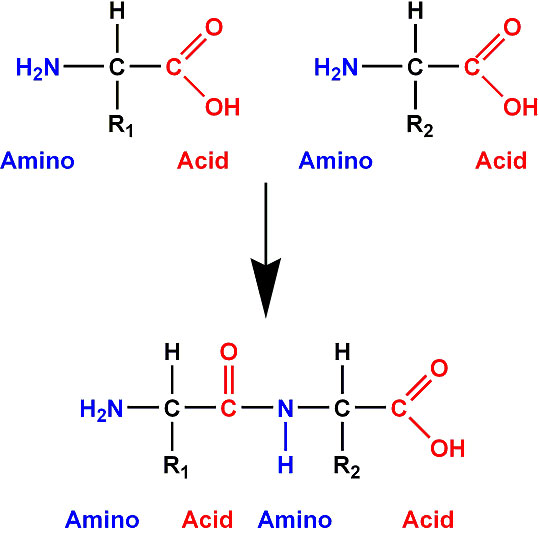
Ligação peptídica
A união estabelecida entre dois aminoácidos adjacentes numa molécula recebe o nome de ligação peptídica. Esse tipo de ligação ocorre sempre por meio da reação entre o grupo amina de um aminoácido e o grupo carboxila do outro.
No momento em que a proteína está sendo sintetizada e as ligações peptídicas estão se formando, o radical carboxila perde um grupamento –OH ( hidroxila), deixando uma ligação livre. Simultaneamente, o radical amina de outro aminoácido perde um átomo de hidrogênio (–H ), ficando, também, com uma ligação livre. Já que existem duas ligações livres, os aminoácidos tendem a se juntar: o OH do grupo carboxila de um aminoácido se liga ao H da amina do vizinho, produzindo uma molécula de água.
No entanto, essa molécula de água produzida não estabelece propriamente a ligação peptídica, umavez que ela é eliminada, sendo assim, a união entre dois aminoácidos consiste numa reação de condensação (ou síntese por desidratação). A ligação peptídica efetivamente ocorre entre o carbono (C) de um aminoácido e o nitrogênio (N) do aminoácido vizinho, classificada como ligação covalente(C-N).
As moléculas que se formam a partir da ligação de aminoácidos são conhecidas como peptídeos. Logo, dois aminoácidos compõem um dipeptídeo, três formam um tripeptídeo, quatro produzem um tetrapeptídeo e assim sucessivamente. Para simplificar esses nomes podem ser usados os termos oligopepídeos para designar moléculas formadas por aminoácidos (do grego oligo, pouco) e polipeptídios, para denominar moléculas compostas por muitos aminoácidos (do grego poli, muitos). Uma proteína, portanto, pertence à categoria dos polipeptídios, já que são constituídas por um número expressivo de aminoácidos.
Uma ligação peptídica é capaz de impedir que a molécula se enrole, o que faz com que as moléculas resultantes apresentem uma estrutura planar. Para romper uma ligação peptídica, é necessário ocorrer uma hidrólise (quebra pela água). Ao adicionar uma molécula de água à cadeia proteica, acontecerá o inverso da formação da ligação peptídica: as ligações livres dos grupamentos carboxila e amina serão “preenchidas” e, dessa forma, a ligação peptídica será quebrada.
Desnaturação
As proteínas são estruturas compostas pela união de diversas moléculas de aminoácidos, através deligações peptídicas, sendo que possui quatro níveis estruturais:
Todas as proteínas iniciam sua existência no ribossomo como uma sequência linear de resíduos de aminoácidos. Esse polipeptídeo deve enovelar-se durante e em seguida à síntese, à fim de atingir a sua conformação nativa. Pequenas alterações no meio em que se localiza a proteína podem resultar em alterações estruturais, que poderá levar à uma deficiência no seu funcionamento.
- Estrutura primária: ligações covalentes unem os resíduos de aminoácidos em uma cadeia polipeptídica.
- Estrutura secundária: são os arranjos particularmente estáveis dos resíduos de aminoácidos, dando origem a padrões estruturais recorrentes.
- Estrutura terciária: descreve todos os aspectos do dobramento tridimensional de um polipeptídeo.
- Estrutura quaternária
: é quando uma proteína possui uma ou mais subunidades polipeptídicas.
A estrutura protéica adquire sua função em meio celular específico. Condições diferentes daquelas presentes no interior da célula podem resultar em variáveis alterações na estrutura das proteínas. Uma perda da estrutura tridimensional suficiente para causar perda de função recebe o nome de desnaturação. O estado desnaturado não necessariamente corresponde à um desenovelamento completo da estrutura protéica e a uma randomização de conformação. Sob a maioria das condições, as proteínas desnaturadas se encontram em um conjunto de estados parcialmente enovelados pouco elucidados.
A maioria das proteínas pode ser desnaturada pelo calor, que afeta as interações fracas em uma proteína (especialmente entre as ligações de hidrogênio) de forma complexa. Quando a temperatura se eleva lentamente, uma conformação protéica geralmente permanece intacta até que haja uma perda abrupta de estrutura em uma faixa estrita de temperaturas. Essa alteração repentina indica que o desenovelamento é um processo cooperativo: a perda da estrutura em uma parte da proteína desestabiliza outras partes.
A desnaturação protéica se dá não só pelo calor, mas também por extremos de pH, por algunssolventes orgânicos miscíveis com a água (álcool e acetona, por exemplo), por certos solutos como uréia e cloridrato de guanidínio ou por detergentes. Cada um desses agentes desnaturantes representa um tratamento relativamente brando no sentido de que nenhuma ligação covalente na cadeia polipepitídica é rompida. Os solventes orgânicos (uréia e detergente) agem principalmente de modo a promover o rompimento de interações hidrofóbicas que estabilizam as proteínas globulares; os extremos de pH alteram a carga líquida da proteína, provocando a repulsão eletrostática e rompimento de algumas ligações de hidrogênio.
Procedimentos para identificação de proteínas
Proteínas são polímeros biológicos com elevadas massas molares formadas por unidades fundamentais (monômeros) denominadas aminoácidos. As proteínas são os componentes químicos mais importantes do ponto de vista estrutural, pois estão presentes em todas as partes da célula. São também fundamentais para o funcionamento do organismo, uma vez que o controle das reações químicas depende das enzimas, que são moléculas de proteínas. Dessa forma, pode-se afirmar que toda enzima um exemplo de proteína, mas nem toda proteína é um exemplo de enzima.
O texto abaixo apresenta algumas técnicas laboratoriais para a caracterização e a identificação de determinadas proteínas, as quais partem da clara do ovo de galinha como solução proteica.
A – PROPRIEDADES GERAIS:
- Quebra-se um ovo de galinha e separa-se a clara e a gema, se faz uma solução adicionando 50mL de água com a clara, e a gema foi descartada;
- Coloca-se 10mL da solução de clara em um béquer e goteja-se três gotas de uma solução grosseira de sulfato de cobre;
- Homogeneíza-se bem e adiciona-se 2,5mL de solução de hidróxido de sódio;
- Observa-se uma coloração roxa.
B – REAÇÕES ESPECÍFICAS:
1 – Reação Xantoprotéica
- Em um tubo de ensaio coloca-se 3mL de solução de clara de ovo e 1mL de HNO3 concentrado, forma-se um precipitado branco;
Aquece-se com muito cuidado por aproximadamente um minuto; - Esfria-se o tubo em água corrente;
- Adiciona-se lentamente ao tubo uma solução de hidróxido de sódio 1M;
- Observa-se duas cores no tubo, amarelo e laranja.
2 – Reação do Biureto
- Em um tubo de ensaio coloca-se 3mL de solução de clara de ovo e 1mL de NaOH 1M, agita-se bem;
- Adiciona-se algumas gotas de solução de sulfato de cobre ao tubo de ensaio;
- Observa-se uma coloração roxa indicando o teste positivo.
3 – Reação do Grupo Sulfídrila (SH)
- Em um tubo de ensaio coloca-se 2mL de solução de clara de ovo e 1mL de NaOH 1M, agita-se bem;
- Ferve-se por aproximadamente 2 minutos;
- Adicionara-se algumas gotas de solução de acetato de chumbo ao tubo de ensaio;
- Observa-se uma coloração escura no tubo.
Abaixo apresenta-se os procedimentos mencionados em um quadro comparativo, o qual resume técnicas básicas para identificação proteica.
IDENTIFICAÇÃO DE
PROTEÍNAS
|
PROCEDIMENTOS
|
RESULTADOS
|
| Reação Xantoprotéica - colocar HNO3 concentrado - aquecer - colocar NaOH(aq)lentamente | Resultado positivo: duas fases, amarelo e laranja | |
| Reação Do Biureto - colocar NaOH - agitar - colocar CuSO4(aq), agitar | Resultado positivo: roxo ou lilás | |
| Reação do Grupo Sulfídrila - colocar NaOH - aquecer - colocar acetato de chumbo | Resultado positivo: cor escura |
Técnicas de Desnaturação de Proteínas
Uma proteína pode ser desnaturada por ação de alguns fatores externos, como, por exemplo, o calor, um meio altamente ácido ou a influência de um metal pesado. Para todos os procedimentos descritos abaixo, pode-se utilizar como solução de proteína a clara do ovo diluída em água. 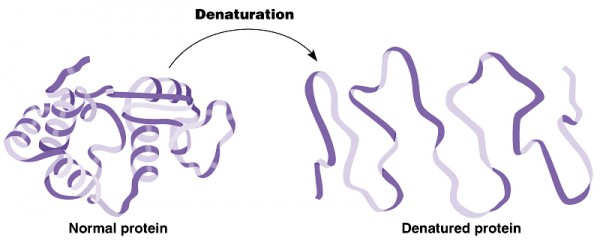
Em um tubo de ensaio colocar 2 mL de solução deproteína e aquecer diretamente na chama se agitar. Observar a formação de coágulo brando de proteína desnaturada.
Explicação: O calor desnatura (precipita) as proteínas, transformando-as em proteínas que são insolúveis por modificação na sua estrutura.
Explicação: Em pH situado do lado alcalino do seu ponto isoelétrico, algumas proteínas combinam-se com cátions de metais pesados formando proteinatos insolúveis. Os sais de metais pesados reagem com seu cátion com o ânion da proteína (COO -) formando proteinatos, no caso de mercúrio de prata e de cobre, estes proteinatos são insolúveis e por isso precipitam.

Precipitação por ação do calor
Precipitação por ação de ácidos
Reação de Heller
Em um tubo de ensaio colocar 1mL de HNO3 concentrado e cuidadosamente pelas paredes do tubo 1mL de solução de proteína, tendo o cuidado para as soluções não se misturarem. Na junção da camada dos dois líquidos se forma um anel branco de albumina precipitada. Outros ácidos fortescomo o HCl e H 2SO 4 também dão testes positivos com a albumina. Repetir técnica utilizando o ácido clorídrico, e anotar diferenças.
Explicação: Os ácidos fortes desnaturam (precipitam) as proteínas, transformando-as em meta proteínas que são solúveis.
Precipitação por sais de metais pesados
Em 3 tubos de ensaio colocar respectivamente 2mL de solução de proteína: no tubo 1 colocar 5 gotas de solução de HgCl2 a 0,5%, no tubo 2 colocar 5 gotas de solução de AgNO3 a 0,5% e no tubo 3 colocar 5 gotas de solução de CuSO4 a 0,5%. Em todos os tubos forma-se um precipitado branco
Precipitação por ação de solventes orgânicos
Em um tubo de ensaio colocar 1mL de solução de proteínas e álcool etílico (1 a 3 volumes) até a formação de precipitado de proteínas.
Explicação: A adição de solventes orgânicos como o etanol, éter dietílico e acetona, quando adicionado às soluções aquosas de proteínas, podem levar à precipitação das mesmas.
Precipitação por reação com agentes alcalóides
Em um tubo de ensaio colocar 1ml de solução albumina de ovo e adicionar 1mL de ácido tricloroacético a 10% (TCA). Observar a formação de um precipitado branco de proteínas desnaturadas.
Explicação: A adição de ácidos orgânicos favorece a precipitação de uma proteína quando em meio aquoso.
Composição química das Proteínas
O tamanho das moléculas de proteínas varia muito, de acordo com seu tipo e função. Existemproteínas com uma única cadeia polipeptídica, enquanto existem outras com duas ou mais cadeias, chamadas de proteínas com multissubunidades, como é o caso da molécula de hemoglobina humana. Essas proteínas podem ter subunidades idênticas (2 ou mais iguais) e recebem o nome deproteína oligomérica. Cada subunidade é chamada de protômero.
O peso molecular também varia muito de acordo com a proteína, que pode ser de 10.000 (proteínas pequenas) a mais de 106 (proteínas com muitas subunidades ou com longas cadeias polipeptídicas).
O número de resíduos de aminoácidos de uma proteína pode ser calculado dividindo seu peso molecular por 110. Essa conta só é válida para proteínas simples, sem outros grupos químicos.
Algumas proteínas, porem, podem ser formadas por grupos diferentes dos aminoácidos. As proteínas que possuem apenas aminoácidos em sua fórmula são chamadas de proteínas simples. As proteínas que contêm outros elementos químicos são chamadas de proteínas conjugadas.
A região da proteína onde está esse elemento é chamado de grupo prostético. É o tipo de grupo prostético que classifica cada grupo de proteínas, por exemplo: proteínas que contêm lipídios são chamadas de lipoproteínas, proteínas que contêm açúcares são chamadas de glicoproteínas, etc.
Pode haver mais de um grupo prostético em uma proteína, e cada um tem a sua função biológica específica.
A seqüência da cadeia de aminoácidos de uma cadeia polipeptídica pode ser determinada. Os polipeptídios pequenos são sequenciados usando procedimentos automatizados. Quando vai se determinar a seqüência de uma cadeia polipeptídica, o primeiro passo consiste em quebrá-la por hidrólise e determinar a composição de aminoácidos e, em seguida, determinar os aminoácidos terminais.
Quando se trata de polipeptídios de cadeias muito grandes, a identificação deve ser feita utilizando pequenos segmentos, pois a precisão tende a diminuir conforme aumenta o tamanho da cadeia.
Funções das Proteínas
As proteínas desempenham um grande número de funções biológicas nas células:
As enzimas são catalisadores biológicos com alta especificidade. É o grupo mais variado de proteínas. Praticamente todas as reações do organismo são catalisadas por enzimas.
Enzimas
Proteínas transportadoras
Podemos encontrar proteínas transportadoras nas membranas plasmáticas e intracelulares de todos os organismos. Elas transportam substâncias como glicose, aminoácidos, etc. através das membranas celulares. Também estão presentes no plasma sanguíneo, transportando íons ou moléculas específicas de um órgão para outro. A hemoglobina presente nos glóbulos vermelhos transporta gás oxigênio para os tecidos. O LDL e o HDL também são proteínas transportadoras.
Proteínas estruturais
As proteínas participam da arquitetura celular, conferindo formas, suporte e resistência, como é o caso da cartilagem e dos tendões, que possuem a proteína colágeno.
Proteínas de defesa
Os anticorpos são proteínas que atuam defendendo o corpo contra os organismos invasores, assim como de ferimentos, produzindo proteínas de coagulação sanguínea como o fibrinogênio e a trombina. Os venenos de cobras, toxinas bactérias e proteínas vegetais tóxicas também atuam na defesa desses organismos.
Proteínas reguladoras
Os hormônios são proteínas que regulam inúmeras atividades metabólicas. Entre eles podemos citar a insulina e o glucagon, que possuem função antagônica no metabolismo da glicose.
Proteínas nutrientes ou de armazenamento
Muitas proteínas são nutrientes na alimentação, como é o caso da albumina do ovo e a caseína do leite. Algumas plantas armazenam proteínas nutrientes em suas sementes para a germinação e crescimento.
Proteínas de motilidade ou contráteis
Algumas proteínas atuam na contração de células e produção de movimento, como é o caso da actina e da miosina, que se contraem produzindo o movimento muscular.
Proteínas
Histórico
As proteínas foram descobertas no século XIX através de estudos realizados principalmente com sangue e ovos. Na época, um dos materiais orgânicos mais estudados eram as claras de ovo de aves, que são chamadas de albume. O fato da clara do ovo se solidificar quando exposta ao aquecimento deixava os cientistas muito intrigados, assim como também acontecia com outras substâncias encontradas no leite e no sangue. Essas substâncias foram chamadas de albuminóides por terem características muito parecidas com o albúmen.
Após anos de pesquisas, foram descobrindo que havia muitos outros compostos albuminóides em nosso corpo.
Proteínas
As proteínas também são muito importantes como agentes estruturais das células, catalisadoras de funções biológicas, proteínas de armazenamento, motilidade, proteínas reguladoras e proteínas de defesa do organismo, como osanticorpos, o fibrinogênio e a trombina.
Em cada célula existem vários tipos de proteínas, cada uma cumprindo uma função específica. Para cada proteína existe um gene para codificá-la.
As proteínas estão entre as macromoléculas mais abundantes e versáteis.
O papel das proteínas, juntamente com os ácidos nucléicos está diretamente relacionado com o controle de todas as funções celulares.
É muito interessante saber que toda essa variedade de proteínas é formada pelo mesmo grupo de 20 aminoácidos.
Proteínas
O que é
A proteína é uma macromolécula formada por pequenas moléculas (menor parte divisível de uma substância) de aminoácido, ela é formada por no mínimo três aminoácidos.
Funções das proteínas
Elas desempenham um papel muito importante em nosso organismo, pois fornecem material tanto para a construção como para a manutenção de todos os nossos órgãos e tecidos.
As proteínas podem ser de origem vegetal ou animal. No caso das primeiras, elas são consideradas incompletas por serem pobres em variedade de aminoácidos essenciais (aqueles que o corpo não é capaz de produzir). Já a proteína de origem animal, é considerada completa por conter todos os aminoácidos essenciais.
Importância
Como já foi citado anteriormente, as proteínas são de extrema importância para o nosso organismo por sua função construtora e reparadora. Elas também participam da formação de hormônios, enzimas e anticorpos. Com estes poucos exemplos, já se pode ter uma idéia do quanto elas são indispensáveis ao nosso organismo.
Quando ingerimos proteínas, elas são quebradas durante o processo de digestão, e posteriormente, absorvidas pelas nossas células, que novamente as quebram, transformando-as em aminoácidos. Estes aminoácidos serão utilizados pelo nosso corpo onde eles forem mais necessários.
Por exemplo, se a pele de uma pessoa estiver em desequilíbrio pela falta de aminoácidos, os alimentos ricos em proteínas e a ingestão devida de água serão benéficos para a sua recuperação. Isso vale não somente para a pele, mas para todo o corpo, pois, como vimos, os aminoácidos são construtores e reparadores.
Vitaminas
As vitaminas são nutrientes essenciais para o organismo e devem estar contidas na dieta. O organismo humano necessita destas vitaminas em pequenas quantidades na dieta para desempenhar diversas funções.
São vitaminas encontradas nos óleos e gorduras dos alimentos. São absorvidas com a ajuda da bile e armazenadas no fígado e no tecido adiposo.
A deficiência de vitaminas é chamada de avitaminose ou hipovitaminose e o excesso é chamado de hipervitaminose. Ambas podem causar danos ao funcionamento do organismo.
As vitaminas são divididas em dois grupos: lipossolúveis e hidrossolúveis.
Vitaminas lipossolúveis
Vitamina A
A vitamina A é um pigmento relacionado com a visão e tem função antioxidante. Participa da defesa imunológica, cornificação da pele e mucosas, constituição da pele, ossos, cabelo e unhas, promove o processo de diferenciação celular e participa do desenvolvimento embrionário.
É encontrada em maior quantidade em alimentos de origem animal, principalmente no fígado e no óleo de peixe. Vegetais possuem beta caroteno que é precursor da vitamina A e é encontrado principalmente nos vegetais alaranjados como a cenoura, abóbora, manga, batata doce, etc. e também verde-escuro como o espinafre.
Muitas pessoas em todo o mundo, principalmente crianças, possuem carência de vitamina A, e pode levar à morte. A falta desta vitamina causa xeroftalmia, também chamada de cegueira noturna.
A vitamina A em excesso é tóxica para o organismo. Pode causar ressecamento e descamação da pele, dores abdominais e nas articulações, crescimento interrompido, danos hepáticos, dores nos ossos, aumento do fígado e do baço, dores de cabeça e malformação de fetos. Alguns medicamentos para combater a acne são á base de ácido retinóico.
Vitamina D
A vitamina D é produzida pelo próprio organismo, com o auxilio da luz solar e interage com hormônios que regulam a quantidade de cálcio no organismo. Ela trabalha como um hormônio e também estimula a maturação das células. É produzida a partir do colesterol, porém pode ser encontrada em alimentos como fígado, gema de ovos e óleos de peixe. Quando uma pessoa se expõe ao sol, os raios ultravioletas são absorvidos e atuam com o colesterol, transformando-o num precursor da vitamina D. Horas depois o fígado e os rins convertem esse precursor em vitamina D.
Os ossos são os principais afetados pela deficiência de vitamina D, causando raquitismo, tanto em crianças como em adultos.
A vitamina D em excesso é a mais tóxica para o organismo, causando náuseas, vômitos, perda de apetite e depósito de cálcio em tecidos moles. O excesso de cálcio no sangue chama-se hipercalcemia e o depósito de cálcio nos vasos chama-se arterosclerose.
Vitamina E
A vitamina E é um poderoso antioxidante, protegendo as células e os compostos da oxidação. O composto que a forma é o tocoferol. Estudos mostram que além do poder antioxidante, ela também pode proteger o organismo contra um câncer, doenças cardiovasculares e aumenta a resposta imunológica do organismo.
É encontrada em vários tipos de alimento e é armazenada em grandes quantidades no tecido adiposo, por isso dificilmente alguém possui deficiência desta vitamina. Caso isso ocorra, em recém nascidos causa anemia e em adultos pode causar problemas neurológicos. Também está associada com a má absorção de gordura e causando prejuízos p/ o fígado, vesícula biliar e pâncreas.
O excesso de vitamina E não é tóxico para o organismo. Existem casos muito isolados de intoxicação por esta vitamina.
Vitamina K
Esta vitamina atua no processo de coagulação sanguínea, produzindo protrombina. A deficiência desta vitamina causa sangramento, dificuldade ou falta de coagulação sanguínea. A vitamina Ktambém atua na constituição dos ossos, prevenindo a osteoporose.
A vitamina K pode ser obtida através da ingestão de vegetais folhosos verdes, fígado, leite, carnes, ovos e frutas. Algumas bactérias quem vivem no intestino sintetizam esta vitamina.
O excesso dela é tóxico para o organismo, provocando lesões no fígado, anemia, icterícia, pois quebra as moléculas de hemoglobina.
Vitaminas hidrossolúveis
Como o nome já diz, são vitaminas solúveis em água. Sua absorção e excreção são bem rápidas.
Vitamina C
A vitamina C participa da produção e manutenção do colágeno, aumenta a absorção de ferro, protege os constituintes do sangue contra a oxidação, acentua a resposta imunológica e ajuda na cicatrização. Também é muito conhecida por prevenir o escorbuto. O consumo de cigarros prejudica a atividade da vitamina C.
Excesso de vitamina C no organismo pode causar cálculos renais.
As principais fontes desta vitamina são frutas e verduras frescas. Pode ser também comercializada como suplemento vitamínico.
São também chamadas de tiamina e riboflavina, respectivamente.
A tiamina atua no metabolismo energético e suas principais fontes são carnes, cereais, nozes, verduras e cerveja. A deficiência de tiamina causa beribéri.
A riboflavina atua no metabolismo energético das células e das enzimas. Os alimentos que contém tiamina também contêm riboflavinas.
Esta vitamina é importante no metabolismo de proteínas, produção de hormônios e atua no crescimento. A falta dela causa fraqueza, insônia, irritabilidade, dermatites, anemias, convulsões e distúrbios de crescimento. O excesso de vitamina B6 pode causar intoxicações neurológicas.
Vitamina B12
Esta vitamina participa da formação das hemácias e na manutenção da bainha de mielina. Para ser absorvida, ela necessita de um fator intrínseco produzido pelo estômago e com a ajuda do suco gástrico se liga á vitamina.
As principais fontes desta vitamina os alimentos de origem animal. A falta dela causa anemia perniciosa, além de danos neurológicos. O excesso de vitamina B12 é eliminado na urina.
Ácido pantotênico (Vitamina B5) e Biotina
Participam do metabolismo energético. O Ácido pantotênico (vitamina B5) estimula o crescimento, participa da síntese de lipídios e produção de hormônios. É encontrado em carnes, ovos, frutas e verduras. O excesso de ingestão causa diarreia.
A biotina participa da síntese de gorduras.
Vitaminas
As vitaminas são substâncias que o organismo não tem condições de produzir e, por isso, precisam fazer parte da dieta alimentar. Suas principais fontes são as frutas, verduras e legumes, mas elas também são encontradas na carne, no leite, nos ovos e cereais.
As vitaminas desempenham diversas funções no desenvolvimento e no metabolismo orgânico. No entanto, não são usadas nem como energia, nem como material de reposição celular. Funcionam como aditivos– são indispensáveis ao mecanismo de produção de energia e outros, mas em quantidades pequenas. A falta delas, porém, pode causar várias doenças, como o raquitismo (enfraquecimento dos ossos pela falta da vitamina D) ou o escorbuto (falta de vitamina C), que matou tripulações inteiras até dois séculos atrás, quando os marinheiros enfrentavam viagens longas comendo apenas pães e conservas.
A Ciência conhece aproximadamente uma dúzia de vitaminas, sendo que as principais são designadas por letras. Essas vitaminas podem ser encontradas em muitos alimentos, especialmente os de origem vegetal.
Vitamina A
 |
A cenoura, por exemplo, é rica em betacaroteno, substância a partir da qual o organismo produz retinol, uma forma ativa de vitamina A.
A vitamina A é importante no crescimento, pois forma ossos e dentes, melhora a pele e o cabelo, protege os aparelhos respiratório, digestivo e urinário e também é importante para a visão.
Outras fontes de vitamina A: leite integral, queijo, manteiga, gema de ovo, pimentão, mamão, abóbora e verduras em geral.
|
Vitaminas do complexo B
Formam um conjunto de vitaminas que têm, entre si, propriedades semelhantes.
A banana contém vitamina B6, que produz energia a partir dos nutrientes, ajuda a formar hemácias (glóbulos vermelhos do sangue) e anticorpos, é útil para os sistemas nervoso e digestivo e boa para a pele. Outras fontes de vitaminas do complexo B: cereais integrais, leguminosas (feijão, soja, grão-de-bico, lentilha, ervilha etc.), alho, cebola, miúdos (moela, coração etc.), peixes, crustáceos, ovos e leite.
A vitamina B12, por exemplo, participa da formação de material genético nas células, essencial à formação de novas células, como hemácias e leucócitos. A vitamina B12, só é encontrada em alimentos de origem animal. Os vegetarianos precisam, portanto, de suplementação desta vitamina. As carnes magras, aves e peixes contêm niacina, que ajuda a produzir energia a partir das gorduras e carboidratos e auxilia também o sistema nervoso e o aparelho digestivo, e vitamina B1, que ajuda na produção de energia, principalmente a necessária aos nervos e músculos, inclusive o coração.
Fontes de vitamina B1
| 
Fontes de vitamina B12
| |

Fontes de vitamina B2
| 
Fontes de vitamina B3
|
Vitamina C
 |
Tomate, laranja, acerola, limão e goiaba são ricos em vitamina C. O ideal é comer esses alimentos crus. A vitamina C preserva ossos, dentes, gengivas e vasos sangüíneos, aumenta a absorção de ferro, ajuda o sistema imunológico e aumenta a cicatrização.
A falta de vitamina C pode causar alguns distúrbios, tais como: anemia, inflamação das mucosas, enfraquecimento dos vasos capilares sangüíneos, podendo ocorrer sangramento em diversas partes do corpo. Todos esses são sintomas de uma doença que é denominada escorbuto.
Outras fontes de vitamina C: abacaxi, caju, mamão,manga, couve-flor e espinafre.
|
Vitamina D
As vitaminas também estão presentes nos alimentos de origem animal, como leite e ovos são ricos em vitamina D (sintetizada pelo próprio organismo, mas que depende do sol para se tornar vitamina D). Esta vitamina é fundamental no fortalecimento dos ossos e dentes e ajuda na coagulação do sangue.

Vitamina K
Entre os alimentos fontes de vitamina K, podemos citar: fígado, óleo de fígado de bacalhau, frutas e verduras como acelga, repolho, couve e alface.
Também contêm vitamina E, que retarda o envelhecimento das células e contribui para a formação de novas hemácias, impedindo sua destruição no sangue.
As verduras e legumes são ricos em vários tipos de vitaminas, mas especialmente o ácido fólico, que é uma das vitaminas do complexo B. Ele colabora na produção de material genético dentro das células e mantêm saudável o sistema nervoso. As verduras, assim como queijos, ovos e leite, também são ricas em vitamina B2 ou riboflavina. A riboflavina estimula a liberação de energia dos nutrientes, ajuda na produção de hormônios e mantêm saudáveis as mucosas

Assinar:
Comentários (Atom)